Primeira bateria de lítio vale o Nobel de Química a trio
Nobel de Química 2019 vai para trio que desenvolveu baterias usadas em celulares e carros elétricos
John B. Goodenough, M. Stanley Whittingham e Akira Yoshino desenvolveram as baterias de íons de lítio. Aos 97 anos, John B. Goodenough passa a ser a pessoa mais velha a ganhar o Nobel.

John B. Goodenough, M. Stanley Whittingham e Akira Yoshino ganhadores do Prêmio Nobel de Química de 2019 pelo desenvolvimento de baterias de íon de lítio — (Foto: Naina Helen Jama / TT News Agency / Reuters)
De celulares a veículos elétricos, baterias revolucionaram a tecnologia e tornaram possível uma sociedade livre de combustíveis fósseis.
O americano John B. Goodenough, o britânico-americano M. Stanley Whittingham e o japonês Akira Yoshino são os vencedores do Prêmio Nobel 2019 de Química pelo desenvolvimento de baterias de íons de lítio, hoje usadas em celulares, notebooks e carros elétricos. A descoberta foi feita no começo da década de 70.
“Os laureados lançaram as bases de uma sociedade sem fio e livre de combustíveis fósseis”, avaliou o comitê do Nobel ao anunciar o prêmio no Twitter.
“Ganhamos acesso a uma revolução técnica”, afirmou Sara Snogerup Linse, membro do comitê e professora de fisicoquímica na Universidade de Lund, na Suécia.
A Academia sueca anunciou em 9 de outubro de 2019, que os cientistas, que trabalharam separadamente, vão dividir de forma igualitária o prêmio de 9 milhões de coroas suecas, equivalente a cerca de R$ 3,72 milhões.
Aos 97 anos, o americano John B. Goodenough passa a ser a pessoa mais velha a ganhar o Nobel. Ele nasceu em 1922 em Jena, na Alemanha, e ocupa a Cadeira Cockrell em Engenharia na Universidade do Texas em Austin, nos Estados Unidos.
O britânico-americano M. Stanley Whittingham, de 77 anos, é professor na Universidade Binghamton, parte da Universidade Estadual de Nova York, também nos Estados Unidos.
O japonês Akira Yoshino, de 71 anos, é professor na Universidade Meijo, em Nagoya, no Japão, e Membro Honorário da corporação Asahi Kasei, em Tóquio.
“A curiosidade foi a principal força motivadora para mim”, disse o cientista durante ligação feita pelo comitê do Nobel logo após o anúncio do prêmio. Ele criou a primeira bateria de íons de lítio comercialmente viável, em 1985.
Entenda a pesquisa
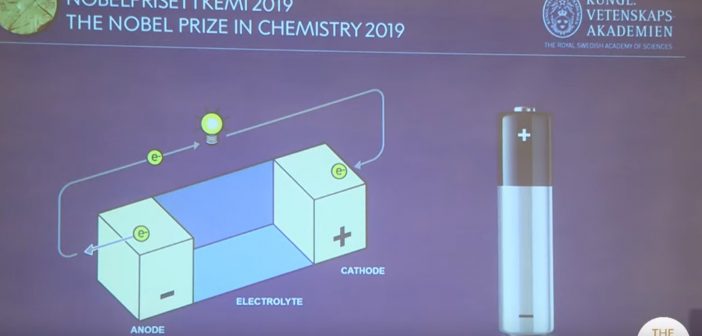
Em uma bateria ou pilha do tipo AA, por exemplo, existem dois polos, chamados de eletrodos: o ânodo (o polo negativo) e o cátodo (polo positivo). Esses eletrodos são separados por meios líquidos ou pastosos que contêm eletrólitos e podem acomodar cargas – os íons.
Os eletrodos são separados por uma barreira que impede que eles encostem um no outro – se isso acontecesse, haveria um curto-circuito.
“Existem reações químicas acontecendo dentro de cada eletrodo”, explicou Olof Ramström, membro do comitê do Nobel e professor de Química na Universidade de Massachusetts em Lowell, nos Estados Unidos. “Isso gera elétrons que passam dentro do circuito elétrico e abastecem o dispositivo em questão”.
“Quando se olha para o desenho, pode parecer relativamente fácil fazer uma bateria, mas esse definitivamente não é o caso. É muito, muito difícil projetar e desenvolver baterias funcionais e eficientes”, afirmou Ramström.
Antes que o modelo de íons de lítio fosse desenvolvido, Stanley Whittingham criou, no início da década de 70, uma bateria com um cátodo (polo positivo) feito de dissulfeto de titânio. No modelo, o ânodo (polo negativo) era feito de lítio metálico – só que o material era muito reativo – o que tornava perigoso recarregar a bateria e levava a explosões.
Tornou-se necessário, então, estabilizar esse material.
O americano John Goodenough previu, então, que o cátodo poderia ter ainda mais potencial se fosse feito usando um óxido de metal em vez de um sulfeto. Depois de muitas buscas, ele demonstrou, em 1980, que o óxido de cobalto, intercalado com íons de lítio, poderia produzir até quatro volts de potencial. Isso foi um achado importante que levou a baterias bem mais poderosas.
Usando o cátodo de Goodenough como base, o japonês Akira Yoshino criou a primeira bateria de íons de lítio comercialmente viável em 1985. Em vez de usar o lítio reativo no ânodo, ele usou um material feito de carbono, o coque de petróleo, que também conseguia armazenar os íons de lítio.
O resultado foi uma bateria leve e resistente que podia ser carregada centenas de vezes antes que seu rendimento começasse a se deteriorar. A vantagem das baterias de íons de lítio é que elas não são baseadas em reações químicas que destroem os eletrodos – mas no fato de os íons de lítio irem e voltarem entre o ânodo e o cátodo.
“Essa transferência de elétrons de um lado para o outro deu mais durabilidade às baterias”, explicou o professor Norberto Peporine Lopes, presidente da Sociedade Brasileira de Química e professor da Faculdade de Ciências Farmacêuticas da USP. A bateria também se tornou mais segura, porque não havia mais traços do lítio metálico.
“O que é muito importante é que ela consegue fazer o processo contrário – se você conectar a um carregador, ou uma fonte de energia, consegue recarregar a bateria”, disse Ramström.
Mas o surgimento da bateria de íons de lítio não significa que os modelos anteriores – de chumbo-ácido e de níquel, por exemplo – deixaram de existir.
“As tecnologias se superpõem. O cádmio é terrível para o meio ambiente, então não é mais usado, mas o níquel ainda se usa em um monte de baterias. Algumas seguem sendo de chumbo-ácido, como as de caixas eletrônicos – que precisam funcionar mesmo que haja uma queda de energia”, explica o professor Roberto Torresi, do Instituto de Química da USP.
O chumbo-ácido, por exemplo, não poderia ser usado em materiais como celulares e notebooks, porque é muito pesada e grande, explica Torresi. Em compensação, é mais barato, então acaba sendo uma boa opção quando o tamanho não é problema.
A partir dos íons de lítio foi possível, ainda, desenvolver materiais em nanoestrutura para aumentar a corrente das baterias. “Isso fez com que a bateria de lítio servisse não só para os eletrônicos, mas também para carros elétricos”, acrescentou o professor.